Công Nghệ Sinh Học
Công cụ chỉnh sửa DNA không tạo vết cắt
- Chi tiết bài viết
- Bài viết liên quan
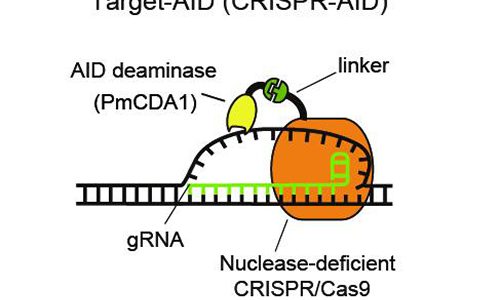
AID deaminase được gắn vào CRISPR/Cas9 protein (được bất hoạt tiểu phần nuclease) bằng 1 đoạn linker. gRNA nhận biết trình tự DNA trên genome đích và enzyme deaminase biến đổi các nucleotides trên mạch DNA mà không tạo nên vết cắt mạch đôi (Đại Học Kobe, Nhật Bản).
Bằng việc kết hợp các thành phần từ hệ miễn dịch của vi khuẩn (CRISPR/Cas9) và hệ miễn dịch của động vật có xương sống (AID hay activation-induced cytidine deaminase), các nhà khoa học tại Đại Học Kobe, Nhật Bản đã phát triển một phương pháp chỉnh sửa DNA hoàn toàn mới, cho phép chỉnh sửa từng nucleotide trên sợi DNA, gọi là kỹ thuật Target-AID.
Sử dụng đặc điểm của enzyme deaminase, có khả năng làm biến đổi các nucleotide đơn lẻ trên DNA, các nhà khoa học đã tạo ra một phiên bản khác của CRISPR/Cas9 với một số đặc điểm nổi bật: tránh các vết cắt không mong muốn trên sợi đôi DNA (double-stranded break), từ đó giảm thiểu sự xuất hiện của các đột biến và cũng không cần sử dụng thêm khuôn DNA cho quá trình chỉnh sửa. Bài báo được công bố trên tạp chí Science ngày 4 tháng 8 là bài báo cáo thứ hai của công cụ chỉnh sửa genome này.
“Những enzyme deaminase giải quyết được vấn đề lớn nhất mà hầu hết các công cụ chỉnh sửa genome trước (bao gồm TALENs, Zinc Finger Nucleases và Cas9) gặp phải, đó là những bản chỉnh sửa chúng ta mong đợi đều gặp phải sự cạnh tranh từ các đột biến thêm hay mất ngẫu nhiên thông qua cơ chế nối không tương đồng ở hai đầu của vết cắt (Non-homologous end-joining hay NHEJ)”, tiến sĩ George Church từ Đại Học Harvard phát biểu – “Hệ thống chỉnh sửa mới này cũng có thể giảm thiểu những nguy cơ từ vết cắt sợi đôi”. Phòng thí nghiệm của TS. George Church cũng đang phát triển công cụ chỉnh sửa nucleotide dựa vào họ enzyme deaminase.
Với hệ thống CRISPR/Cas9, các nhà khoa học chỉnh sửa trình tự DNA bằng cách vận chuyển protein Cas9 vào trong tế bào để tạo các vết cắt sợi đôi và sử dụng khuôn DNA để tế bào chỉnh sửa tại vị trí vết cắt đó. Quá trình chỉnh sửa này dựa vào bộ máy sửa chữa DNA tương đồng của tế bào, nhưng các bộ máy sửa chữa khác, bao gồm NHEJ, cạnh tranh để hoạt động tại vị trí vết cắt, thường tạo ra những đột biến mất hay thêm đoạn/điểm không mong muốn.
“Trong quá trình sửa chữa vết cắt sợi đôi, rất nhiều hoạt động diễn ra tại cùng một thời điểm và thỉnh thoảng các nucleotides bị cắt xén hay thêm vào hoặc thậm chí bị đột biến theo những cách mà chúng ta không thể kiểm soát được”, đồng tác giả bài báo Akihiko Kondo, Đại Học Kobe, Nhật Bản cho biết.
Để tạo ra công cụ chỉnh sửa genome này, Kondo và công sự đã kết hợp một biến thể của protein Cas9 với tiểu phần nuclease được bất hoạt, không có khả năng tạo vết cắt trên DNA sợi đôi hoặc một biến đổi khác của Cas9 – “nickase” Cas9 – có khả năng tạo vết khía / vết cắt mạch đơn cùng với enzyme activation-induced cytidine deaminase (AID). Enzyme AID thường tạo ra các đột biến trên immunoglobulin và các gene mã hóa cho các loại kháng thể để tạo ra sự đa dạng cho hệ miễn dịch. Enzyme AID hoạt động trên mạch đơn DNA, thay thế base cytosine (C) thành base uracil (U), và do đó sẽ chuyển thành thymine (T) ở lần nhân đôi DNA kế tiếp.
Bộ máy chỉnh sửa genome này được kiểm tra khả năng chỉnh sửa một loại marker chọn lọc trên chủng nấm men thiếu hệ thống enzyme nội bào tương tự AID, nhóm nghiên cứu đã phát hiện ra rằng khi bộ máy tác động vào gene CAN1 nhờ sự dẫn đường của gRNA, tần suất đột biến trên gene CAN1 tăng 1000 lần khi so sánh với chủng nấm men không có sự xuất hiện của bộ máy này. Sử dụng công cụ giải trình tự toàn bộ genome, các nhà khoa học đã chứng minh rằng rất ít các đột biến không mong muốn (off-target) cùng với chỉ một tỉ lệ tăng nhẹ trong tỉ lệ đột biến tổng thể.
“Tỉ lệ đột biến (với sự có mặt của AID) là có thể chấp nhận được, chưa tới 10 lần cao hơn khi so sánh với tỉ lệ đột biến tổng thể trong tự nhiên”, đồng tác giả bài báo Keiji Nishida nói.
Các nhà khoa học cũng trình bày khả năng tạo đồng thời những biến đổi trên 2 gene bằng cách biểu hiện 2 đoạn RNA dẫn đường (gRNA) riêng biệt cùng với bộ máy Cas9-deaminase trong tế bào.
Một điểm đáng chú ý nữa được chỉ ra trong công bố này đó là nếu protein nickase Cas9 tạo vết cắt trên mạch bổ sung với mạch diễn ra sự thay thế các nucleotides sẽ mang lại hiệu quả cao hơn so với hệ thống sử dụng protein Cas9 với tiểu phần Nuclease bị bất hoạt. Bởi vì hoạt động sửa chữa mất nucleotide có thể sửa chữa những nucleotide được thay thế bởi AID, “nếu vết khía (nick) được tạo ra ở mạch bổ sung, thì sẽ không còn khuôn để bộ máy sửa chữa có thể dùng để chỉnh sửa đột biến thay thế nữa”, và điều đó làm quá trình thay thế các nucleotide có hiệu quả hơn, Nishida giải thích.
Hơn nữa, các nhà khoa học cũng bổ sung thêm một enzyme – uracil-DNA glycosylase inhibitor – vào bộ máy Cas9-deaminase, làm tăng hiệu quả của bộ máy trong việc thay thế cytosine thành thymine và giảm thiểu sự phát sinh các đột biến mất Nu ngẫu nhiên trên các dòng tế bào động vật.
Bộ máy chỉnh sửa genome được biến đổi này cũng hoạt động hiệu quả trên các dòng tế bào động vật, và kết quả tạo ra rất ít các đột biến không mong muốn. Ở nấm, sự biểu hiện của tất cả các biến thể của bộ máy chỉnh sửa DNA cho thấy sự phát triển tế bào tốt hơn so sánh với tế bào biểu hiện hệ thống CRISPR/Cas9 truyền thống, gợi ý rằng công cụ mới này ít độc hại hơn với tế bào.
Bộ máy nhân tạo (Target-AID) được tạo nên từ sự kết hợp của CRISPR/Cas9 mất hoạt tính nuclease và enzyme AID cũng cho thấy sự hiệu quả trong quá trình đột biến có chủ đích. Theo công bố được dẫn ra trong bài báo, đột biến điểm (mong muốn) xảy ra chủ yếu ở cystidine trong phạm vi tác động 5 bases. Các nhà khoa học cũng công bố một số biến thể khác cho công cụ chỉnh sửa DNA của họ – sử dụng deaminase từ chuột – với phạm vi tác động trong khoảng từ 3 tới 6 nucleotides.
Theo Church, những phát triển trên công cụ này cho các ứng dụng trong điều trị cần nhiều hơn những kiểm nghiệm ngặt nghèo về các đột biến không mong muốn có thể xảy ra. Một câu hỏi mở khác được nhấn mạnh là làm thế nào để tác động chính xác tới một cystosine mà không ảnh hưởng tới các cystosine bên cạnh.
Theo Kondo, nhóm nghiên cứu cũng đang tiếp tục phát triển các hệ thống khác bao gồm Cas9 và các enzyme khác (ví dụ như adenosine deaminase) để tạo ra một công nghệ chỉnh sửa DNA toàn diện với khả năng thay thế bất kì một trong bốn nucleotides.
Vũ Hồng Ái (tổng hợp)
Bài báo tham khảo:
- K. Nishida et al., “Targeted nucleotide editing using hybrid prokaryotic and vertebrate adaptive immune systems,” Science, doi:10.1126/science.aaf8729, 2016.
- CRISPR: No Cutting Required, The-scientist.com
- DNA Can Be Edited Without Being Cut, Gen News Hightlights
Xin mời Quý Độc Giả bỏ ra 2-5 phút để làm một khảo sát mức độ hài lòng về bài viết của IBSG tại đây. IBSG chân thành cảm ơn Quý Độc Giả.