Công Nghệ Sinh Học
Công cụ CRISPR siêu chính xác được tăng cường nhờ thiết kế enzyme
- Chi tiết bài viết
- Bài viết liên quan
Cải thiện trong phương pháp chỉnh sửa base có thể đưa tới một liệu pháp gen an toàn hơn.
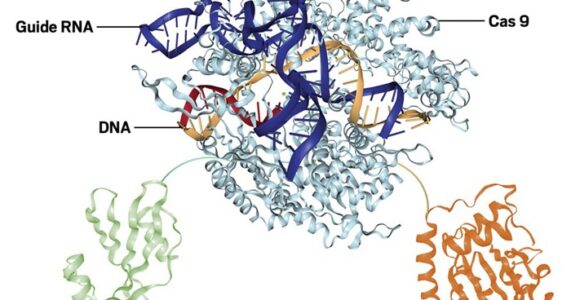
Phiên bản siêu chính xác của công cụ chỉnh sửa bộ gen CRISPR trở nên tốt hơn bao giờ hết. Các nhà nghiên cứu đã nâng cấp độ chính xác của hệ thống CRISPR-Cas9 tuy phổ biến nhưng hay gây lỗi, bằng cách thiết kế enzyme chỉnh sửa DNA không gây ra nhiều đột biến không mong muốn.
Enzyme này, được công bố vào ngày 10 tháng 2 trên tạp chí Nature Biotechnology, tạo ra một phương pháp gọi là chỉnh sửa base, phương pháp này cho phép các nhà nghiên cứu chuyển đổi một chữ cái trên DNA thành một chữ khác, một công cụ khả thi hơn cho việc điều trị các bệnh di truyền.
Một nucleotide, về căn bản, gồm ba thành phần: một gốc đường deoxyribose, một nhóm phosphate, và một bazơ nitơ. Có bốn loại bazơ nitơ – guanine, cytosine, adenine và thymine – tương ứng với bốn loại nucleotide khác nhau cấu thành nên chuỗi sợi DNA. Các nucleotide được nối dài với nhau qua liên kết 3′-5′ phosphodiester tạo thành chuỗi sợi đơn DNA. Khi hai sợi đơn DNA liên kết bổ sung qua liên kết hydro, sợi DNA mạch đôi sẽ hình thành. Trong kỹ thuật chỉnh sửa base (base editing), enzyme được thiết kế để biến đổi hóa học một bazơ nitơ này thành một bazơ nitơ khác mà không làm đứt gãy liên kết 3′-5′ phosphodiester. Chính vì thế nó có cái tên chỉnh sửa base (chỉnh sửa bazơ nitơ).
“Kỉ nguyên của chỉnh sửa bộ gen người vẫn đang ở những bước đầu non trẻ, và tất cả chúng ta đều có một phần trách nhiệm trong việc làm tất cả những gì có thể để giảm thiểu tối đa những rủi ro do tác dụng phụ gây ra, đặc biệt khi những công cụ này bắt đầu đi vào thử nghiệm lâm sàng”. dẫn lời của David Liu – nhà hóa sinh thuộc Broad Institute of MIT và Harvard in Cambridge, Massachusetts.
Sự khác biệt giữa CRISPR-Cas9 truyền thống và chỉnh sửa base
Chỉnh sửa base đã nhanh chóng nhận được sự ưu ái của các nhà nghiên cứu. Cả chỉnh sửa CRISPR-Cas9 truyền thống (conventional CRISPR–Cas9 editing) và chỉnh sửa base (base editing) đều sử dụng enzyme Cas9 hướng đích DNA thông qua trình tự dẫn sgRNA được thiết kế sẵn. Trong chỉnh sửa CRISPR-Cas9 truyền thống, các nhà nghiên cứu sử dụng enzyme Cas9 để cắt cả hai mạch DNA (làm đứt gãy liên kết 3′-5′ phosphodiester ở cả hai mạch), sau đó dựa vào cơ chế sửa chữa DNA có trong tế bào để đưa những thay đổi vào trình tự DNA tại vị trí đó. Phương thức này có thể hiệu quả, nhưng hơi khó để kiểm soát trình tự được sửa thành.
Ở chỉnh sửa base, khả năng cắt DNA của Cas9 bị bất hoạt, và dung hợp với một enzyme khác có khả năng chuyển đổi mã DNA từ một chữ cái này thành một chữ cái khác.Ví dụ như enzyme có khả năng chuyển đổi C-G thành A-T (Cystocine base editors -CBEs). Trong chỉnh sửa base, Cas9 chỉ làm nhiệm vụ hướng đích. Nhiều bệnh di truyền người – ví dụ như bệnh hồng cầu hình liềm – có thể chỉ gây ra bởi thay đổi một chữ cái có trên DNA vì vậy chỉnh sửa base là một phương pháp hấp dẫn cho xử lý những rối loạn kiểu vậy.
Phương pháp chỉnh sửa base, lần đầu tiên được mô tả năm 2016. Vào thời gian đó kho lưu trữ sinh học phi lợi nhuận Addgene ở Watertown, Massachusetts, đã phân phối 8.000 công cụ chỉnh sửa base tới hàng ngàn phòng thí nghiệm. Chưa đầy bốn năm kể từ khi Liu và đồng nghiệp lần đầu tiên mô tả kỹ thuật này, Công ty Beam Therapeutics ở Cambridge, Massachusetts, do Liu là đồng sáng lập đã thương mại hóa công nghệ, đã đưa ra công chúng, huy động 180 triệu đô la Mỹ.
Sàng lọc enzyme chỉnh sửa base có độ tin cậy cao
Tuy nhiên kỹ thuật vẫn cần được tối ưu. Năm ngoái, các nhà nghiên cứu công bố rằng enzyme dùng để thay đổi base C thành T không chỉ tác động lên vị trí mục tiêu mà còn ở cả những vị trí ngẫu nhiên khác trên bộ gen. Việc sửa sai mục tiêu làm dấy lên lo ngại về việc sử dụng kỹ thuật này cho liệu pháp gen trên người, bởi vì chỉnh sửa DNA trật mục tiêu có thể gây hại. Phần thách thức là những thay đổi này nằm rải rác ngẫu nhiên trên khắp bộ gen, và chỉ có thể phát hiện chúng bằng cách giải trình tự toàn bộ bộ gen được chỉnh sửa – một phương án giải quyết đắt đỏ và đầy trở ngại.
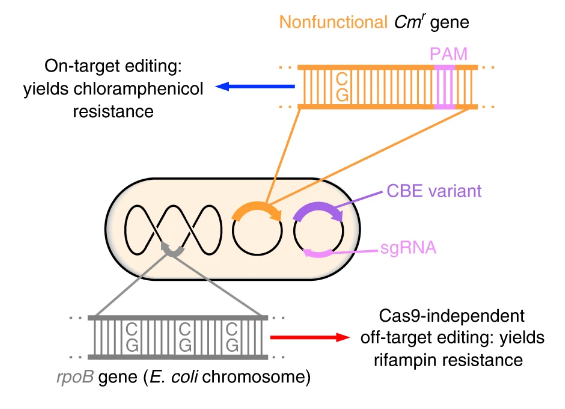
Liu và đồng nghiệp đã phát triển cách thức sàng lọc enzyme chỉnh sửa base có độ tin cậy cao hơn. Phương pháp này dựa vào tính kháng kháng sinh của vi khuẩn. Cụ thể là “ tần suất mà tế bào vi khuẩn trở nên kháng kháng sinh càng cao, thì enzyme càng chủ động hơn trong việc làm biến đổi DNA ở các gen kháng”.
Thử nghiệm kháng kháng sinh đươc mô tả như sau. Ban đầu họ kiểm tra hoạt tính khử amine hóa cytocine không phụ thuộc Cas9 trong vi khuẩn. Đột biến C-G thành T-A ở gen rpoB giúp E.coli kháng lại rifampin. Nhóm tác giả xây dựng giả thiết rằng: khi biến nạp một plasmid mã cho CBE với hoạt tính khử amin không phụ thuộc Cas9, vi khuẩn sẽ kháng rifampin ở tần suất mà tại đó phản ánh mức độ hoạt tính của enzyme khử amine hóa. Họ đặt tên cho phương pháp này là ‘thử nghiệm kháng rifampin vi khuẩn’. Đồng thời để đánh giá hoạt tính trúng đích của enzyme CBE, họ biến nạp thêm 2 loại plasminds. Một là plasmid mã hóa cho enzyme chloramphenicol acetyltransferase, enzyme kháng kháng sinh này bị bất hoạt tính do một đột biến điểm C-G trên trình tự mã hoá. Hai là plasmind mã hoá sgRNA hướng CBE đến vị trí đích để đảo ngược đột biến C-G thành T-A. Hoạt tính khử amine hóa giúp đảo đột biến C-G thành T-A, vì vậy vi khuẩn có khả năng sống sót được trong môi trường có chloramphenicol. Khả năng vi khuẩn sống sót càng cao thì càng phản ảnh được hiệu quả chỉnh sửa gen trúng mục tiêu của CBE. Vì vậy, với thử nghiệm này, tác nhân được chọn là tác nhân kháng với rifampin thấp trong khi có hoạt tính kháng chloramphenicol cao.
Caixia Gao, nhà thực vậy học ở Chinese Academy of Sciences’s (CAS) Institute of Genetics and Developmental Biology ở Beijing (Bắc Kinh), cho hay: phương pháp sàng lọc của Liu còn thú vị hơn là chính bản thân enzyme. Vài enzyme sửa base không hoạt động tốt ở tế bào thực vật, vậy nên phương pháp này có thể giúp sàng lọc những enzyme hoạt động trên đối tượng chuyên biệt.
Joseph Ngo (chuyển ngữ)
Trần Thị Hải Yến (hiệu đính)
Nguồn
Heidi Ledford. Super-precise CRISPR tool enhanced by enzyme engineering. Nature. February 10, 2020.
Jordan L.Doman et al., Evaluation and minimization of Cas9-independent off-target DNA editing by cystosine base editors, Nature Biotechnology, Feb 2020.
Nguồn ảnh: Chemical & Engineering News